新闻网讯 11月8日,国际生物学杂志《核酸研究》(Nucleic Acids Research)发表我校药学院吴曈勃教授和同济医学院附属同济医院戴俊教授等人最近的研究成果“基于光控解离和链置换协同调控CRISPR-Cas12a的方法(Photocontrolleddissociation and toehold-mediated strand displacement-based synergistic regulation of CRISPR-Cas12a)”。研究发现激活剂中间位置插入修饰基团时可抑制Cas12a反式切割活性,利用Toehold介导的链置换反应与紫外光控进行Cas12a活性状态的转换,为Cas12a的活性调控提供新途径。
研究表明,现有Cas12a调控策略通常仅能实现Cas12a由“关闭”到“开启”的单向调控,而对已激活的Cas12a缺乏有效的抑制手段。因此开发对Cas12a活性进行双向精准调控,可进一步拓宽Cas12a应用范围,在分子诊断、DNA电路等领域具有重要意义。
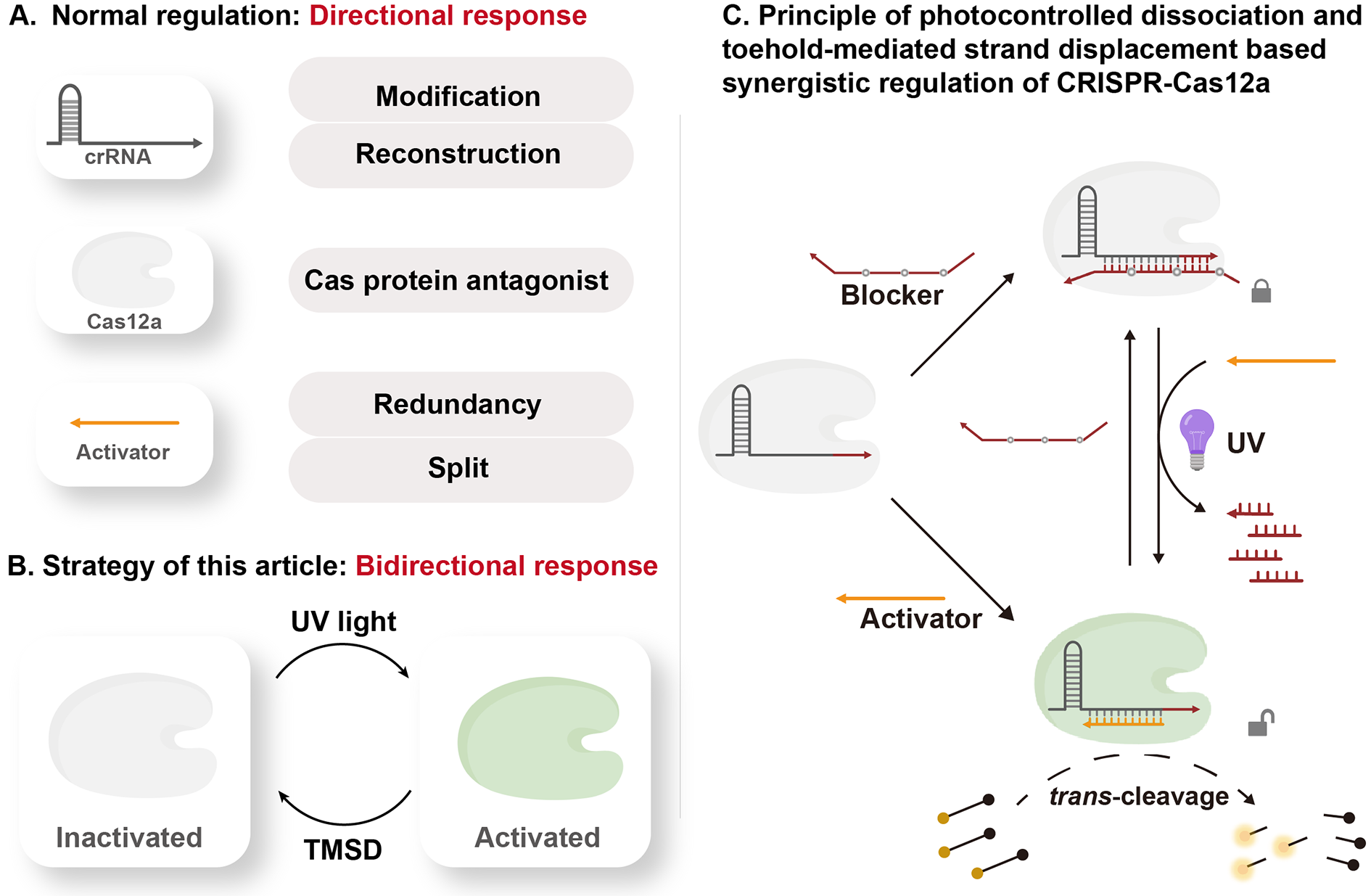
图为光控解离与Toehold介导的链置换反应协同调控CRISPR-Cas12a反式切割活性机制。
团队报告一种新型Cas12a活性调控策略:在激活剂中间位置引入修饰基团形成气泡结构时,可转变为阻滞剂,有效抑制Cas12a反式切割活性。当修饰基团设计为可响应外部刺激的光敏基团PC-Linker时,可在光照条件下促使阻滞剂裂解,从而在正常激活剂存在时,恢复Cas12a的反式切割活性。这种调控手段无需对Cas12a及其crRNA进行额外设计。团队已证明两种活性状态可通过Toehold介导的链置换反应与紫外光照进行转换,从而实现对Cas12a反式切割活性的可逆双向精准调控。基于此,团队结合DNA密码学,开发了一种分层时间授权系统,为Cas12a在更加复杂的生物网络中提升其反应兼容性提供了新的思路。
药学院2023级硕士生吴佳妮为第一作者。
相关链接:
https://academic.oup.com/nar/article/53/20/gkaf1178/8317322
